
09 Sep Ozonoterapia y Neumonía | COVID-19
Ozonoterapia para pacientes con neumonía por COVID-19: Informe preliminar de un estudio prospectivo de casos y controles

AlbertoHernández / Department of Anesthesiology & Perioperative Medicine, Policlinica Ibiza Hospital, Ibiza, Spain
MontserratViñals/ Department of Internal Medicine, Policlinica Ibiza Hospital, Ibiza, Spain
- AsunciónPablos /Department of Internal Medicine, Policlinica Ibiza Hospital, Ibiza, Spain
- FranciscoViláscPeter JPapadakos / Department of Intensive Care Medicine, University of Rochester, Rochester, NY, USA
- Duminda N.Wijeysundera/ Department of Anesthesiology & Perioperative Medicine, St Michael Hospital, Toronto, Canada
- Sergio D.Bergese/ Departments of Anesthesiology & Neurological Surgery, Stony Brook University, Stony Brook, NY, USA
- MarcVives/ Department of Anesthesiology & Perioperative Medicine, Hospital Universitari de Girona Dr J Trueta, Girona, Spain
- Recibido el 9 de noviembre de 2020, revisado el 23 de noviembre de 2020, aceptado el 27 de noviembre de 2020, disponible en línea el 5 de diciembre de 2020.
- Número de registro del ensayo clínico: NCT04444531
Artículo original: https://bit.ly/3DTpBmm
Puntos destacados:
-La sangre ozonizada se asoció a un menor tiempo de mejora clínica.
-La sangre ozonizada se asoció con mayores tasas de mejora clínica en el día 14.
-La sangre ozonizada se asoció con un menor tiempo de disminución de los marcadores inflamatorios.
Resumen
Antecedentes
Todavía no hay estrategias de tratamiento específicas para la COVID-19, aparte del manejo de apoyo.
Diseño
Estudio prospectivo de casos y controles determinado por el ingreso en el hospital según la disponibilidad de camas.
Participantes
Dieciocho pacientes con infección por COVID-19 (confirmada por el laboratorio) con neumonía grave ingresados en el hospital entre el 20 de marzo y el 19 de abril de 2020. Los pacientes ingresados en el hospital durante el periodo de estudio fueron asignados a diferentes camas en función de la disponibilidad de las mismas. Dependiendo de la cama en la que ingresara el paciente, el tratamiento fue autohemoterapia con ozono o tratamiento estándar. Los pacientes del grupo de casos recibieron sangre ozonizada dos veces al día a partir del día del ingreso durante una media de cuatro días. Cada tratamiento consistió en la administración de 200 mL de sangre total autóloga enriquecida con 200 mL de mezcla de oxígeno-ozono con una concentración de ozono de 40 μg/mL.
Resultados principales
El resultado primario fue el tiempo transcurrido desde el ingreso hospitalario hasta la mejoría clínica.
Resultados
Nueve pacientes (50%) recibieron autohemoterapia con ozono a partir del día del ingreso. La autohemoterapia con ozono se asoció con un tiempo más corto hasta la mejoría clínica (mediana [IQR], 7 días [6-10] frente a 28 días [8-31], p = 0,04) y mejores resultados a los 14 días (88,8% frente a 33,3%, p = 0,01). En los análisis ajustados al riesgo, la autohemoterapia con ozono se asoció con un tiempo medio más corto hasta la mejora clínica (-11,3 días, p = 0,04, IC del 95%: -22,25 a -0,42).
Conclusión:
La autohemoterapia con ozono se asoció con un tiempo significativamente menor hasta la mejoría clínica en este estudio prospectivo de casos y controles. Dado el pequeño tamaño de la muestra y el diseño del estudio, estos resultados requieren una evaluación en ensayos controlados aleatorios más amplios.
1. Introducción
La pandemia de COVID-19 ha provocado más de 28,7 millones de casos y 920.847 muertes en todo el mundo hasta septiembre de 2020 [1]. Alrededor del 15% de los adultos infectados desarrollan una neumonía grave que requiere oxígeno suplementario, y un 5% adicional evoluciona hacia un síndrome de dificultad respiratoria aguda (SDRA) que requiere ventilación mecánica a menudo durante varias semanas [2], [3].
Las medidas de apoyo siguen siendo la piedra angular del tratamiento de la COVID-19 en ausencia de terapias específicas. Los beneficios biológicos potenciales de la autohemoterapia con ozono incluyen la reducción de la hipoxia tisular, la disminución de la hipercoagulabilidad, la modulación de la función inmunitaria con la inhibición de los mediadores inflamatorios, la mejora de la función fagocítica y el deterioro de la replicación viral [4], [5], [6], [7], [8], [9], [10], [11], [12], [13].
El ozono podría mejorar la circulación sanguínea y el suministro de oxígeno al tejido isquémico [4], [5], [6], [7] como resultado del efecto concertado del óxido nítrico [8], el aumento del nivel intraeritrocitario de 2,3 -DPG [9] y el aumento de algunas prostaciclinas como la PGI2 [10]. Estos efectos pueden ayudar a disminuir la hipercoagulación que se ha observado en pacientes con COVID-19 [11]. Otro papel importante que juega el ozono en la COVID-19 es su efecto inmunomodulador. La respuesta inflamatoria es un sello distintivo de la infección severa y la modulación de las citoquinas es clave para evitar el deterioro del paciente. El ozono es capaz de modular y controlar las citoquinas liberando citoquinas antiinflamatorias y reduciendo la actividad de las proinflamatorias como la IL-1, IL-6 y TNF-α contrarrestando el estado de hiperinflamación observado en los pacientes de COVID, pero además, el ozono tiene potentes propiedades antiinflamatorias a través de la modulación del inflammasoma NLRP3 que se reconoce que juega un papel crucial en el inicio y la continuación de la inflamación en varias enfermedades [12]. El ozono también puede modular la acumulación de neutrófilos a nivel local, la expresión de IL-6, TNF-α, y la albúmina modificada por la isquemia en los riñones, así como aumentar la capacidad antioxidante local [13].
La ozonoterapia consiste en la administración de una mezcla de gas con un 97% de oxígeno y un 3% de ozono generada por un generador de ozono médico. El ozono es una molécula formada por tres átomos de oxígeno que comparten los mismos electrones. Como no hay suficientes electrones para todos, el ozono es una molécula relativamente inestable. Esta inestabilidad es la razón por la que es un estimulante biológico tan potente [14]. La ozonoterapia puede administrarse de forma sistémica añadiéndolo a una muestra de sangre del propio paciente y reinfundiéndola después, en lo que se denomina «autohemoterapia ozonizada».
El ozono es un gas natural producido a partir de átomos de oxígeno. Los átomos de oxígeno individuales no pueden aguantar solos sin reagruparse en moléculas de oxígeno diatómicas. En esta fase de recombinación, algunos átomos se transformarán en oxígeno triatómico poco unido. Esta nueva molécula de trioxígeno se llama ozono y se encuentra en la estratosfera, donde absorbe varias radiaciones ultravioletas para protegernos. Su peso molecular es de 48 g/mol con una solubilidad en agua de 0,57 g/L a una temperatura de 20 °C, (unas diez veces mayor que el oxígeno). En consecuencia, la gran solubilidad del ozono en el agua permite su reacción inmediata con cualquier compuesto soluble y biomoléculas presentes en los fluidos biológicos.
El ozono es generado por dispositivos médicos con fines médicos. El ozono médico se obtiene a partir de oxígeno puro haciéndolo pasar por un gradiente de alto voltaje (5-13 KV). Así se obtiene una mezcla de gases compuesta por un 97% de oxígeno y no más de un 3% de ozono. Termodinámicamente es inestable y se revierte espontáneamente en oxígeno. Las concentraciones que van de 10 a 70 μg/ml se utilizan habitualmente con fines médicos. Existen múltiples vías para la administración de ozono con fines médicos. La vía de inhalación puede ser tóxica para el sistema pulmonar y otros órganos. Sin embargo, la autohemoterapia con ozono ha demostrado ser segura en múltiples ensayos clínicos aleatorios, estudios observacionales y meta-análisis [15]. La incidencia de efectos secundarios de la ozonoterapia es muy baja (estimada en un 0,0007%), y se manifiesta típicamente como euforia, náuseas, dolores de cabeza y fatiga [16]. En general, es una terapia muy segura cuando se administra correctamente, con la dosis recomendada. Se han descrito complicaciones como la embolia gaseosa [17], pero están causadas por prácticas de administración incorrectas y por el uso de equipos no certificados.
Varios países como España, Italia, Grecia, Cuba, Rusia, Portugal y Turquía han incorporado la ozonoterapia en la práctica médica para otras indicaciones [18].
La patogénesis del virus es variable y no se conoce del todo. Afecta predominantemente a los pulmones, donde el daño alveolar difuso con afectación de la microcirculación conduce a una marcada hipoxia [19], [20]. Existe una desregulación de la respuesta inmunitaria y la linfocitopenia es un rasgo distintivo en la gran mayoría de estos pacientes [21]. La inmunidad innata y las vías de coagulación están estrechamente relacionadas [22]. La activación de los macrófagos asociada a la COVID-19, la hiperferritinemia, la tormenta de citoquinas, la liberación de patrones moleculares asociados a patógenos y las proteínas moleculares asociadas al daño pueden dar lugar a la liberación del factor tisular y a la activación de los factores de coagulación que crean una predisposición a la hipercoagulabilidad [22].
Otros han comunicado, como informes de casos, el uso de la autohemoterapia con ozono en pacientes con neumonía grave por COVID-19; sin embargo, tenían limitaciones [23], [24], [25]. Recientemente se ha publicado un estudio retrospectivo de casos y controles sobre 60 pacientes con neumonía por COVID-19 de leve a moderada [26].
Por lo tanto, realizamos un estudio prospectivo de casos y controles determinado por el ingreso en el hospital en función de la disponibilidad de camas para determinar si la autohemoterapia con ozono se asociaba a un menor tiempo de mejora clínica en los pacientes con neumonía grave por COVID-19.
2. Materiales y métodos
2.1. Diseño del estudio
Este estudio prospectivo de casos y controles se llevó a cabo en el Hospital Policlínico de Ibiza (España). Se llevó a cabo de acuerdo con la Declaración de Helsinki y fue aprobado por un comité ético de investigación humana (CEH) multidisciplinar de la institución. Cada participante dio su consentimiento informado por escrito para la administración de cualquier intervención, la recogida de datos clínicos relevantes y la determinación de los resultados. El estudio consistió en todos los adultos (de edad ≥ 18 años) que ingresaron en el hospital con un diagnóstico de neumonía grave COVID-19 entre el 20 de marzo y el 19 de abril de 2020. Todos los pacientes incluidos cumplían los siguientes criterios: infección confirmada por COVID-19 (diagnosticada mediante un hisopo nasofaríngeo realizado en el momento del ingreso); neumonía con anomalías en la radiografía de tórax de referencia; saturación de oxígeno <94% en aire ambiente, y taquipnea con frecuencia respiratoria superior a 30 por minuto.
Los pacientes ingresados en el hospital durante el periodo de estudio fueron asignados a diferentes camas en función de la disponibilidad de las mismas. Dependiendo de la cama en la que ingresaba el paciente, el tratamiento era autohemoterapia con ozono o tratamiento estándar.
2.2. Tratamiento clínico estándar
El tratamiento de todos los pacientes con neumonía por COVID-19 incluía oxigenoterapia suplementaria, hidroxicloroquina, lopinavir/ritonavir, corticosteroides y antibióticos (incluida la azitromicina) a discreción del médico que atendía a cada paciente. Las dosis de los fármacos fueron las estándar: ceftriaxona 2gr q24h durante 5 días, levofloxacino 500 mg q12h, hidroxicloroquina 400 mg q24h durante 4 días, dexametasona 6 mg q24h durante 10 días o metilprednisolona 40 mg q12h y azitromicina 500 mg q24h durante 3 días. No se administró remdesivir ni tocilizumab a ningún paciente. Se utilizó enoxaparina 1 mg/kg SC q12h como dosis de anticoagulación terapéutica. Las decisiones sobre la intubación endotraqueal, la ventilación mecánica y el ingreso en la unidad de cuidados críticos se tomaron siguiendo las normas clínicas y a discreción del médico que atendía al paciente.
2.3. Autohemoterapia con ozono
Se administró sangre ozonizada dos veces al día durante 5 días consecutivos. La autohemoterapia ozonizada consistió en la infusión intravenosa de sangre autóloga ozonizada. Inicialmente, se extrajeron 200 mL de sangre total autóloga de la vena antecubital del paciente en una bolsa de recogida de sangre desechable de plástico estándar (bolsa SANO3 certificada) que contenía 35 mL de solución anticoagulante de citrato de dextrosa (ACD-A). A continuación, la sangre se enriqueció con 200 mL de mezcla gaseosa oxígeno-ozono con una concentración de ozono a 40 μg/mL obtenida por Ozonobaric P Sedecal, un generador de ozono con certificado CE0120 tipo IIb. La sangre ozonizada se reinfundió en la misma vena durante aproximadamente 10-15 min [26].
2.4. Resultados
2.4.1. Resultado primario
El resultado clínico primario fue el tiempo de mejora clínica durante el ingreso hospitalario.
2.4.2. Evaluación clínica
La mejoría clínica se definió como una reducción de dos puntos (en relación con el estado del paciente al ingreso en el hospital) en una escala ordinal de seis puntos, o el alta con vida del hospital, lo que ocurriera primero. La escala de seis puntos era la siguiente: muerte (6 puntos); oxigenación por membrana extracorpórea o ventilación mecánica que requería intubación (5 puntos); ventilación no invasiva u oxigenoterapia de alto flujo (4 puntos); oxigenoterapia sin necesidad de oxígeno de alto flujo o ventilación no invasiva (3 puntos); ingreso hospitalario sin necesidad de oxigenoterapia (2 puntos); y alta hospitalaria o alcanzar los criterios de alta (1 punto). Los criterios de alta fueron como evidencia de recuperación clínica (normalización de la pirexia, frecuencia respiratoria <24 por minuto, saturación de oxígeno >94% en aire ambiente y ausencia de tos) durante al menos 72 h.
Esta escala de seis puntos y la definición de mejora clínica (es decir, una mejora de dos puntos en la escala) se ha utilizado en investigaciones anteriores sobre la intervención para relacionar la infección por COVID-19 [28]. El personal que verificó los resultados no estaba cegado en cuanto a si los pacientes recibieron la atención habitual o la autohemoterapia con ozono.
2.4.3. Resultados secundarios
Los resultados secundarios fueron la mejoría clínica medida en los días 7, 14 y 28 después del ingreso en el hospital. También se midió diariamente el tiempo hasta una disminución del doble de las concentraciones de proteína C reactiva, ferritina, dímero D y lactato deshidrogenasa. Otros resultados secundarios fueron los siguientes: días sin ventilación en el día 28, tasa de intubación, duración de la estancia hospitalaria, mortalidad intrahospitalaria y a los 28 días y tiempo (días) hasta que la PCR COVID-19 fue negativa. El seguimiento finalizó en el momento del alta hospitalaria, la muerte del paciente o a los 31 días del ingreso hospitalario, lo que ocurriera primero.
2.4.4. Análisis estadístico
Todos los análisis se realizaron con la versión 13.0 de STATA (StataCorp. 2013. Software estadístico Stata: Release 13. College Station, TX: StataCorp LP). La significación estadística se definió por un valor P de dos caras inferior a 0,05. Se utilizó la prueba de Shapiro-Wilk para determinar si las variables estaban distribuidas normalmente. A continuación, se calcularon las diferencias no ajustadas entre los brazos de tratamiento y de control mediante la prueba t de dos muestras (variables continuas con distribución normal), la prueba U de Mann-Whitney (variables continuas con evidencia de distribuciones no normales) y la prueba exacta de Fisher (variables categóricas). Se compararon los tiempos no ajustados de mejora clínica entre los dos brazos del estudio mediante curvas de supervivencia de Kaplan-Meier y la prueba de rango logarítmico. Los pacientes fueron censurados en el momento del alta hospitalaria, de la muerte o a los 31 días del ingreso hospitalario, lo que ocurriera primero. La asociación ajustada entre la autohemoterapia con ozono y el tiempo medio hasta la mejoría clínica se estimó mediante un modelo de regresión lineal multivariable que se ajustó a la edad, el sexo y la puntuación inicial de la Evaluación Rápida de la Insuficiencia Orgánica (SOFA). Estas covariables se preespecificaron en función de su importancia clínica. A los pacientes que no habían logrado una mejora clínica dentro del periodo de seguimiento se les asignó un valor temporal de 31 días. Se incluyeron en la cohorte del estudio todos los pacientes ingresados en el centro de estudio dentro de un periodo pragmático de un mes.
3. Resultados
La cohorte incluyó 18 pacientes. La edad media era de 68 años (DE 15 años) y el 72,2% (n = 13) eran hombres. Las características basales de estos pacientes se presentan en la Tabla 1. En total, 9 pacientes (50%) recibieron autohemoterapia con ozono. Las características basales de los dos brazos del estudio fueron cualitativamente similares, aparte de la edad (la media de edad fue mayor en el brazo de atención habitual), el peso (la media de peso fue mayor en el brazo de atención habitual) y el índice de masa corporal (el valor medio fue mayor en el brazo de atención habitual únicamente).
Tabla 1. Características basales.
Ozonated Autohemotherapy (n = 9) |
Usual Clinical Care (n = 9) | p-value | |
| Age, mean (SD), years | 64 (11) | 71 (18) | 0.35 |
| Male sex, n (%) | 7 (78%) | 6 (67%) | 1 |
| Weight, mean (SD), kg | 74 (17) | 85 (23) | 0.25 |
| Height, mean (SD), cm | 167 (10) | 170 (7) | 0.48 |
| Body mass index, mean (SD), kg/m2 | 26.2 (4.5) | 29.5 (7.1) | 0.26 |
| Hypertension, n (%) | 4 (44%) | 6 (67%) | 0.34 |
| Diabetes mellitus, n (%) | 0 (0%) | 2 (22%) | 0.47 |
| Chronic pulmonary disease, n (%) | 2 (22%) | 1 (11%) | 1 |
| Chronic cardiac disease, n (%) | 1 (11%) | 2 (22%) | 1 |
| Previous stroke, n (%) | 0 (0%) | 0 (0%) | 1 |
| Baseline hemoglobin, mean (SD), mg/dL | 13 (2.1) | 13 (3.0) | 0.51 |
| Baseline Quick SOFA score of 2 or 3, n (%) | 1 (11%) | 1 (11%) | 1 |
| Baseline 6-point ordinal scale, median [IQR] | 3 [3–3] | 3 [2–3] | 0.60 |
| Baseline Lactate Dehydrogenase, mean (SD), U/L | 487 (168) | 506 (123) | 0.80 |
| Baseline C-reactive protein, median ([IQR]), mg/L | 2,9 [0,5–7,7] | 4,3 [1,8–9] | 0.50 |
| Baseline ferritin, median ([IQR], ug/L | 556 [226–1,171] | 290 [163–880] | 0.63 |
| Baseline D-dimer, median ([IQR], ng/mL | 943 [459–1,930] | 389 [215–468] | 0.16 |
| Baseline platelets, median ([IQR], ×109/L | 302 [263–408] | 180 [155–211] | 0.05 |
| Baseline SpO2/FiO2 ratio, median [IQR] | 350 [255–408] | 339 [261–452] | 0.96 |
| Treatment | |||
| Hydroxychloroquine, n (%) | 4 (44%) | 3 (33%) | 0.23 |
| Lopinavir/ritonavir, n (%) | 1 (11%) | 2 (22%) | 1 |
| Corticosteroids, n (%) | 2 (22%) | 1 (11%) | 1 |
| Ceftriaxone, n (%) | 1 (11%) | 1 (11%) | 1 |
| Levofloxacin, n (%) | 2 (22%) | 2 (22%) | 1 |
| Azithromycin, n (%) | 8 (89%) | 7 (78%) | 1 |
| Therapeutic anticoagulation, n (%) | 0 (0%) | 2 (22%) | 1 |
IQR: Rango intercuartil. DE: Diferencia estándar. SOFA: Evaluación secuencial del fallo orgánico.
3.1. Resultado primario: Tiempo hasta la mejoría clínica
La autohemoterapia con ozono se asoció con un tiempo significativamente menor hasta la mejoría clínica (mediana [IQR], 7 días [6-10] frente a 28 días [8-31], p = 0,04) (Fig. 1 y Tabla 2). En los análisis de regresión lineal no ajustados, el tiempo medio hasta la mejoría clínica fue 12,4 días más corto en el brazo de autohemoterapia con ozono (-12,4 días; p = 0,01; IC del 95%: -22,49 a -2,39). En los análisis de regresión lineal ajustados, el tiempo medio hasta la mejoría clínica en el brazo de autohemoterapia con ozono fue 11,3 días más corto (-11,3 días; p = 0,04; IC del 95%: -22,25 a -0,42). Se llevó a cabo un análisis de sensibilidad post-hoc que se ajustó por edad, SOFA rápido y peso, todas ellas características basales con diferencias cualitativas entre los brazos del estudio. La diferencia ajustada en el tiempo hasta la mejoría clínica (-11,6 días, p = 0,05, IC del 95%: -23,3 a 0,41) fue cualitativamente similar en este análisis de sensibilidad. Los tiempos no ajustados hasta la mejoría clínica utilizando las curvas de supervivencia de Kaplan-Meier y la prueba de rango logarítmico mostraron una diferencia significativa entre los grupos (Log Rank (Mantel-Cox) Chi-cuadrado 4,182. p = 0,041) (Fig. 1).
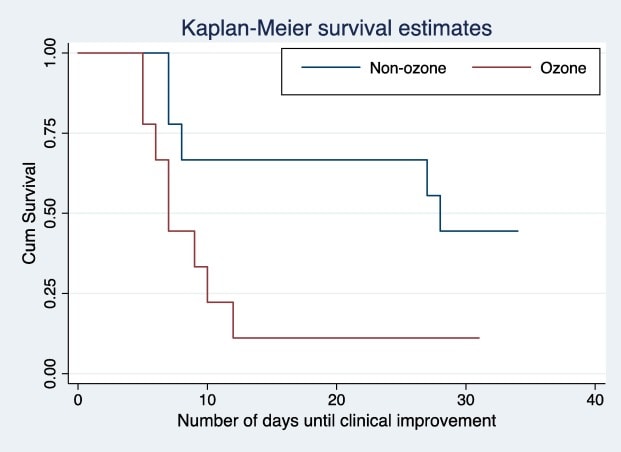
Fig. 1. Kaplan-Meier survival curves.
Tabla 2. Resultados.
| Ozonated Autohemotherapy (n = 9) | Usual Clinical Care (n = 9) | p-value | |
| Primary outcome | |||
| Time to clinical improvement, median [IQR], days | 7 [6–10] | 28 [8–31] | 0.04 |
| Secondary outcomes | |||
| Clinical improvement at day 7, n (%) | 4 (44%) | 2 (22%) | 0.31 |
| Clinical improvement at day 14, n (%) | 8 (89%) | 3 (33%) | 0.01 |
| Clinical improvement at day 28, n (%) | 8 (89%) | 5 (56%) | 0.29 |
| 6-point ordinal scale day 7, median [IQR] | 2 [1–2] | 2 [1–4] | 0.45 |
| 6-point ordinal scale day 14, median [IQR] | 1 [1] | 1 [1–4] | 0.29 |
| 6-point ordinal scale day 28, median [IQR] | 1 [1] | 1 [1–2] | 0.30 |
| Time to Temperature <37C, median [IQR], days | 1 [1–1.5] | 4 [2–5] | 0.10 |
| Time to PCR COVID-19 negative, mean (SD), days | 13.1 (5.7) | 21.4 (7.4) | 0.05 |
| Time to a 2-fold decreased C-reactive protein, median [IQR], days | 3.5 [3–28] | 13 [8–25] | 0.008 |
| Time to a 2-fold decreased D-dimer, median [IQR], days | 4 [1–10] | 19.5 [10–28] | 0.009 |
| Time to a 2-fold decreased ferritin, median [IQR], days | 8 [5–10] | 15 [10–25] | 0.016 |
| Time to a 2-fold decreased Lactate Dehydrogenase, median [IQR], days | 9 [7–9] | 25 [12–26] | 0.01 |
| Ventilator-free days at day 28, median [IQR], days | 28 [28] | 28 [0–28] | 0.14 |
| Intubation required, n (%) | 0 (0%) | 2 (22.%) | 0.47 |
| ICU-length of stay, median [IQR], days | 0 [0–0] | 0 [0–0] | 0.24 |
| Hospital-length of stay, median [IQR], days | 8 [7–12] | 28 [8–31] | 0.09 |
| In-hospital mortality, n (%) | 1 (11%) | 2 (22%) | 1 |
| 28-day hospital mortality, n (%) | 1 (11%) | 2 (22%) | 1 |
UCI: Unidad de Cuidados Intensivos. IQR: Rango intercuartil. DE: Diferencia estándar. SOFA: Sequential Organ Failure Assessment (Evaluación secuencial del fallo orgánico).
3.2. Resultados secundarios
La autohemoterapia con ozono se asoció a una mejora clínica en el día 14 (88,8% frente a 33,3%, p = 0,01). La autohemoterapia con ozono también se asoció con un tiempo más corto para una disminución de dos veces la proteína C reactiva (3. 5 días [3], [4], [5], [6], [7], [8], [9], [10], [11], [12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23], [24], [25], [26], [27], [28] frente a 13 días [8], [9], [10], [11], [12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23], [24], [25], p = 0. 008), ferritina (8 días [5], [6], [7], [8], [9], [10] frente a 15 días [10], [11], [12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23], [24], [25], p = 0. 016), dímero D (4 días [1], [2], [3], [4], [5], [6], [7], [8], [9], [10] frente a 19. 5 días [10], [11], [12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23], [24], [25], [26], [27], [28], p = 0. 009) y Lactato Deshidrogenasa (9 días [7], [8], [9] frente a 25 días [12], [13], [14], [15], [16], [17], [18], [19], [20], [21], [22], [23], [24], [25], [26], p = 0,01). El tiempo medio para obtener resultados negativos en las pruebas de PCR COVID-19 se redujo [13,1 (DE 5,7) frente a 21,4 (DE 7,4 días), p = 0,05). No hubo diferencias con respecto a los días libres de ventilación en el día 28 (mediana [IQR], 28 días [28] vs 28 días [0-28], p = 0,14) o la mortalidad a los 28 días (11,1% vs 22,2%; p = 1). No se observaron acontecimientos adversos ni efectos no deseados en ambos grupos. Ninguno de los pacientes de ambos grupos fue tratado con ventilación mecánica no invasiva.
4. Discusión
En este estudio prospectivo de casos y controles de 18 pacientes con neumonía grave por COVID-19 confirmada, la autohemoterapia con ozono dos veces al día durante 5 días consecutivos se asoció con una reducción significativa del tiempo hasta la mejoría clínica. Este estudio de casos y controles proporciona nuevos datos que apuntan al papel potencial de la autohemoterapia con ozono para el tratamiento de la neumonía grave por COVID-19.
Nuestros hallazgos son coherentes con las revisiones recientes que describen los posibles beneficios biológicamente plausibles asociados a la autohemoterapia con ozono para la COVID-19 [29], [30], [31], [32] y también son coherentes con un estudio retrospectivo de casos y controles publicado recientemente [26].
Tascini et al. en su estudio de casos y controles [26], sobre 60 pacientes con neumonía por COVID-19 de leve a moderada, tratados en ambos grupos con la mejor terapia disponible, mostraron una asociación entre el uso de la ozonización de la sangre y una disminución significativa en el fenotipo clínico SIMEU según la Sociedad Italiana de Medicina de Urgencias y Emergencias (2,87 ± 0,78 frente a 2,27 ± 0,83, p < 0,001) desde el inicio hasta el alta. Mientras que en el grupo de control no hubo diferencias estadísticamente significativas. Además, la mejora clínica asociada al uso de O3 fue mayor en comparación con el grupo de control (53% frente a 33%). En el grupo de casos, sólo el 7% de los pacientes tuvo un peor resultado, en comparación con el 17% del grupo de control. Al igual que en nuestra cohorte, no se observaron acontecimientos adversos asociados al tratamiento con sangre ozonizada. Entre los 30 pacientes tratados con sangre ozonizada (grupo de casos), 28 recibieron tres sesiones consecutivas y 2 recibieron dos dosis consecutivas durante 3 días. La dosis utilizada fue de 200 mL de mezcla de gases oxígeno-ozono con una concentración de ozono de 40 μg/mL. En nuestro estudio se recibió la misma dosis. Sin embargo, se administró dos veces al día durante 5 días, en lugar de 3 sesiones diarias como hicieron ellos. En nuestra opinión, el criterio de valoración primario del estudio de Tascini et al. era algo confuso. Hubo una disminución en el fenotipo clínico del SIMEU desde el inicio hasta el alta y la mejora clínica asociada al uso del O3 fue mayor en comparación con el grupo de control (53% frente al 33%). Sin embargo, no hubo diferencias en la estancia hospitalaria (9,37 ± 3,84 frente a 9,37 ± 5,38; p = 1).
La autohemoterapia con ozono tiene un papel potencial en el tratamiento de pacientes con neumonía grave COVID-19, con varios mecanismos de acción biológicamente plausibles. Cuando la sangre humana se expone a una mezcla gaseosa de oxígeno y ozono, el oxígeno se equilibra con el agua extracelular e intraeritrocítica antes de unirse a la hemoglobina hasta oxigenarse por completo. Por el contrario, el ozono, más soluble que el oxígeno, se disuelve fácilmente en el agua y reacciona instantáneamente con las biomoléculas, como los aminoácidos (especialmente la cisteína, el triptófano, la metionina, la fenilalanina y la tirosina) y con los lípidos (especialmente los ácidos grasos insaturados contenidos en los fosfolípidos de las membranas). Los primeros pueden producir disulfuros y sulfóxido de metionina; los segundos pueden producir peróxido de hidrógeno, aldehídos e hidroxihidroperóxidos. Los compuestos generados durante las reacciones [especies reactivas de oxígeno (ROS) y productos de la ozonización de lípidos (LOPs)] representan los «mensajeros del ozono» y son responsables de sus efectos biológicos y terapéuticos [33] por lo que el ozono puede ser considerado como un pro-fármaco que produce mensajeros bioquímicos.
En cuanto a la acción potencial específica del ozono contra los coronavirus y la eficacia del ozono contra los patógenos es bien conocida. El ozono parece ser el mejor agente disponible para la esterilización del agua [34], aunque se desconoce la actividad virucida in vivo del ozono en la dosis utilizada en el presente estudio. Se ha sugerido que el ozono podría actuar como una molécula de señal en el organismo, siendo generado por los neutrófilos humanos y siendo necesario para la formación de anticuerpos [35] que juegan un papel en la respuesta humoral natural a la infección [36]. El ozono también es capaz de inducir la liberación y modulación de IFN-γ, TNF-α y factores estimulantes de colonias [37], [38], y también es capaz de modular y estimular la función fagocítica [39], [40], lo que puede tener un efecto muy positivo en la infección por COVID-19.
Por último, el ozono puede perjudicar la replicación viral, como se sugiere en sus efectos sobre el SARS y el MERS [41]. Los receptores celulares de la enzima convertidora de angiotensina tipo 2 (ACE2) han sido identificados como receptores del SARS-CoV-2 [42], que podrían ser bloqueados con anticuerpos monoclonales específicos pero también a través del control del factor nuclear eritroide 2-relacionado (Nrf2) que regula y bloquea la actividad de este receptor [43]. Debido a que el ozono es capaz de causar una rápida activación de Nrf2 [44], [45], parece muy probable que este pueda ser un importante mecanismo fisiológico para bloquear la reduplicación endógena de COVID-19 al impedir el contacto con este receptor. Además, la proteína spike (S) es responsable de la unión del receptor y la fusión de la membrana [46]. Contiene un dominio transmembrana altamente conservado que consiste en tres partes: un dominio N-terminal rico en triptófano, un dominio central y un dominio C-terminal rico en cisteína. Se ha demostrado que tanto el dominio rico en cisteína como el dominio rico en triptófano son necesarios para la fusión [46], [47], [48]. Tanto la cisteína como el triptófano, son sensibles a la oxidación. Se ha planteado la hipótesis de que los metabolitos del ozono podrían oxidar los residuos de cisteína, dificultando la entrada del virus en la célula huésped e impidiendo la replicación viral [49].
Este estudio de prueba de concepto señala la necesidad de realizar más investigaciones, como un ensayo clínico aleatorio multicéntrico bien diseñado y con buena potencia. Las limitaciones incluyen que el tamaño de la muestra de nuestra cohorte es pequeño y monocéntrico. Los IC del 95% para nuestras estimaciones ajustadas fueron amplios, y no excluyen una disminución del 20-30% en el coeficiente de tiempo (días) hasta la mejora clínica. Los evaluadores de resultados no estaban cegados a la asignación del brazo de tratamiento. El grupo que recibió autohemoterapia con ozono era ligeramente más joven y tenía un índice de masa corporal más bajo. Sin embargo, se realizó un análisis de sensibilidad post-hoc ajustado por edad, índice de masa corporal rápido y peso, y el análisis ajustado confirmó los resultados. Además, al tratarse de un estudio observacional no se pudo medir la IL-6 ni otras citocinas. Los puntos fuertes de este estudio incluyen su población pragmática del mundo real COVID-19, el uso de un resultado clínico primario objetivo y el ajuste del riesgo mediante métodos de análisis de modelos de regresión.
En conclusión, la autohemoterapia con ozono se asoció con un tiempo significativamente más corto para la mejora clínica y un tiempo más corto para una disminución de dos veces de la proteína C reactiva, la ferritina, el dímero D y la deshidrogenasa láctica en los pacientes con neumonía COVID-19 grave en este estudio prospectivo de casos y controles.
Financiación
No hay ningún apoyo financiero para este estudio.
Declaración de contribución de los autores del CRediT
Alberto Hernández: Conceptualización, Redacción – revisión y edición. Montserrat Viñals: Investigación, Validación, Curación de datos. Asunción Pablos: Investigación, Validación, Curación de datos. Francisco Vilás: Investigación, Validación, Curación de datos. Peter J Papadakos: Redacción – revisión y edición, Supervisión, Curación de datos. Duminda Wijeysundera: Redacción – revisión y edición. Sergio D. Bergese: Redacción – revisión y edición. Marc Vives: Redacción – borrador original, análisis formal.
Declaración de intereses competitivos
Los autores declaran que no tienen intereses financieros en competencia conocidos ni relaciones personales que pudieran parecer influir en el trabajo presentado en este artículo.
Agradecimientos
El Dr. Vives afirma que ha enumerado a todas las personas que han contribuido significativamente al trabajo.
El Dr. Wijeysundera cuenta con el apoyo de un premio al mérito del Departamento de Anestesiología y Medicina del Dolor de la Universidad de Toronto y de la Cátedra de Investigación en Anestesiología Traslacional del Hospital St.
REFERENCIAS:
[1]Johns Hopkins University and Medicine; COVID-19 map Johns Hopkins Coronavirus Resource Centre, https://coronavirus.jhu.edu/map.html. Google Scholar
[2]N. Chen, M. Zhou, X. Dong, et al.
[3]F. Zhou, T. Yu, R. Du, et al.
[4]R. Giunta, A. Coppola, C. Luongo, et al.
[5]X.N. Wu, T. Zhang, J. Wang, et al.
[6]R.V. Borroto, H.L.B. Lima, G.S. Lima, et al.
[7]S. Pandolfi, A. Zammitti, M. Franzini, et al.
[8]R.M. Bateman, M.D. Sharpe, C.G. Ellis
[9]V. Bocci
[10]S. Schulz, S. Ninke, B. Watzer, et al.
[11]E. Terpos, I. Ntanasis-Stathopoulos, I. Elalamy, et al.
[12]G. Yu, Z. Bai, Z. Chen, et al.
[13]E.B. Sancak, H. Turkon, S. Cukur, et al.
[14]N.L. Smith, A.L. Wilson, J. Gandhi, S. Vatsia, S.A. Khan
[15]R. Viebahn-Hänsler, O. León Fernández, Z. Fahmy
[16]M.T. Jacobs
[17]D. Chirchiglia, P. Chirchiglia, C. Stroscio, et al.
[18]Madrid. Community of Madrid, Ministry of Health, Directorate General of Management and Inspection. Director General of Management and Inspection, Manuel Molina Muñoz. Letter of March 9, 2009 addressed to AEPROMO. www.aepromo.org. Members area, legislation, Spain. Google Scholar
[19]L. Carsana, A. Sonzogni, A. Nasr, et al.
[20]J.A. Rubano, P.T. Jasinski, D.N. Rutigliano, et al., Tracheobronchial Slough, a Potential Pathology in Endotracheal Tube Obstruction in Patients With Coronavirus Disease 2019 (COVID-19) in the Intensive Care Setting, Ann Surg. 2020, 10.1097/SLA.0000000000004031. Google Scholar
[21]W.J. Guan, Z.Y. Ni, Y. Hu, et al.
[22]M. Delvaeye, E.M. Conway
[23]Z. Zheng, M. Dong, K. Hu
[24]A. Hernández, M. Viñals, T. Isidoro, et al.
[25]M. Franzini, L. Valdenassi, G. Ricevuti, et al.
[26]C. Tascini, G. Sermann, A. Pagotto, et al., Blood ozonization in patients with mild to moderate COVID-19 pneumonia: a single centre experience, Int. Emerg. Med. 2020. Nov 1, doi: 10.1007/s11739-020-02542-6.
[27]B. Hu, J. Zheng, Q. Liu, Y. Yang, Y. Zhang
[28]Y. Wang, D. Zhang, G. Du, et al.
[29]A. Hernandez, P.J. Papadakos, A. Torres, et al.
[30]M.E. Fernández-Cuadros, M.J. Albaladejo-Florín, D. Peña-Lora, S. Álava-Rabasa, O.S. Pérez-Moro
[31]R.J. Rowen, H. Robins
[32]L. Valdenassi, M. Franzini, G. Ricevuti, L. Rinaldi, A.C. Galoforo, U. Tirelli
[33]V. Bocci, C. Aldinucci
[34]WHO. Disinfectants and Disinfection By-Products. Available in: https://www.who.int/water_sanitation_health/dwq/S04.pdf.
[35]B.M. Babior, C. Takeuchi, J. Ruedi, et al.
[36]P. Wentworth Jr., J.E. McDunn, A.D. Wentworth, et al.
[37]L. Notarangelo, J.L. Casanova, A. Fisher, et al.
[38]L. Paulesu, E. Luzzi, V. Bocci
[39]J. Diaz-Luis, S. Menendez-Cepero, A. Diaz-Luis, et al.
[40]B.W. Frush, Z. Li, J.V. Stiles, et al.
[41]V. Gérard, M.D. Sunnen, SARS and ozone therapy: Theoretical considerations [cited in 2003]. Available from: http://www.triroc.com/sunnen/topics/sars.html.
[42]H. Zhang, J.M. Penninger, Y. Li, N. Zhong, A.S. Slutsky
[43]M. Sagai, V. Bocci
[44]A. Pecorelli, V. Bocci, A. Acquaviva, et al.
[45]L. Re, G. Martínez-Sánchez, M. Bordicchia, et al.
[46]K.W. Chang, Y. Sheng, J.L. Gombold
[47]I.G. Madu, S. Belouzard, G.R. Whittaker
[48]Y. Liao, S.M. Zhang, T.L. Neo, et al.
[49]P.H. Dussault, A.D. George, T.K. Trullinger
[50]A. Hernández, M. Viñals, A. Pablos, et al., Ozone therapy for patients with COVID-19 pneumonia: a Quasi-Randomized Controlled Trial, medRxiv, 2020, 2020.06.03.20117994.



